1. Introducción
La lucha contra el cáncer ha dado lugar a numerosos avances científicos y médicos en las últimas décadas. Uno de los desarrollos más significativos es la inmunoterapia, que se ha convertido en un pilar fundamental del tratamiento oncológico. Entre sus innovaciones, la inmunoterapia DEX, basada en exosomas derivados de células dendríticas, ha adquirido gran importancia, avalada por más de 15,600 publicaciones indexadas en PubMed. Esta terapia representa la evolución de los descubrimientos que llevaron al Premio Nobel de Medicina en 2011, destacando el papel de las células dendríticas en la activación del sistema inmune para combatir tumores.
2. Contexto Global de la Inmunoterapia DEX
El desarrollo y la expansión de la inmunoterapia DEX han sido notables, abarcando actualmente más de 80 centros en casi 30 países, principalmente en Europa, Estados Unidos y Medio Oriente. Sin embargo, su disponibilidad en América Latina sigue siendo limitada debido a los altos costos que conlleva una terapia de precisión personalizada, restringiendo su acceso a un número reducido de centros en la región.
3. El Programa Oncovix: Un Caso de Éxito Internacional
En América Latina, ya se ha logrado desplegar amplia cobertura geográfica, gracias a programas de admisión telemática y aplicación home care oncologya (aplicación domiciliaria), entre los que destaca el programa Oncovix, que ha sido un referente en la adopción de inmunoterapia DEX. Este programa inició en Chile en 2017 y al año siguiente 2018 obtuvo apoyo del Ministerio de Economía y CORFO parac los centros Recell y Biogénica CIAP, como una línea de desarrollo biotecnológico destinada a exportación, que fue evolucionando posteriormente en Barcelona, España, donde se perfeccionaron las técnicas con tecnología biotecnológica de Estados Unidos. Entre sus consultores expertos, destaca el Dr. Ramón Gutiérrez, oncopatólogo reconocido como uno de los líderes en inmunoterapia en Iberoamérica, quien junto a un equipo multidisciplinario integra oncología de precisión, patología y Big Data para desarrolor I+D en oncotecnología de alto impacto.
4. Beneficios y Avances en la Terapia Basada en Exosomas Dendríticos
Los exosomas derivados de células dendríticos pulsadas constituyen un avance crucial en la inmunoterapia. Estas nanopartículas biológicas actúan como «mensajeros» del sistema inmune, reprogramándolo para identificar y atacar células tumorales. Desde 2011, la evidencia científica ha respaldado su eficacia en el control y remisión del cáncer, demostrando alta seguridad y ausencia de reacciones adversas significativas. Publicaciones internacionales destacan su capacidad para superar las deficiencias inmunológicas inducidas por el cáncer, optimizando la respuesta inmune del paciente.
5. Composición y Mecanismos Terapéuticos
La composición de la terapia DEX se basa en exosomas derivados de células dendríticas, que son producidos en condiciones controladas y enriquecidos con moléculas inmunomoduladoras. Estas sustancias, de origen natural en el cuerpo humano, se administran en niveles optimizados para reforzar el sistema inmune y eliminar células cancerígenas. Este enfoque personalizado ha demostrado eficacia en tumores sólidos y metástasis, marcando un cambio en el paradigma del tratamiento oncológico.
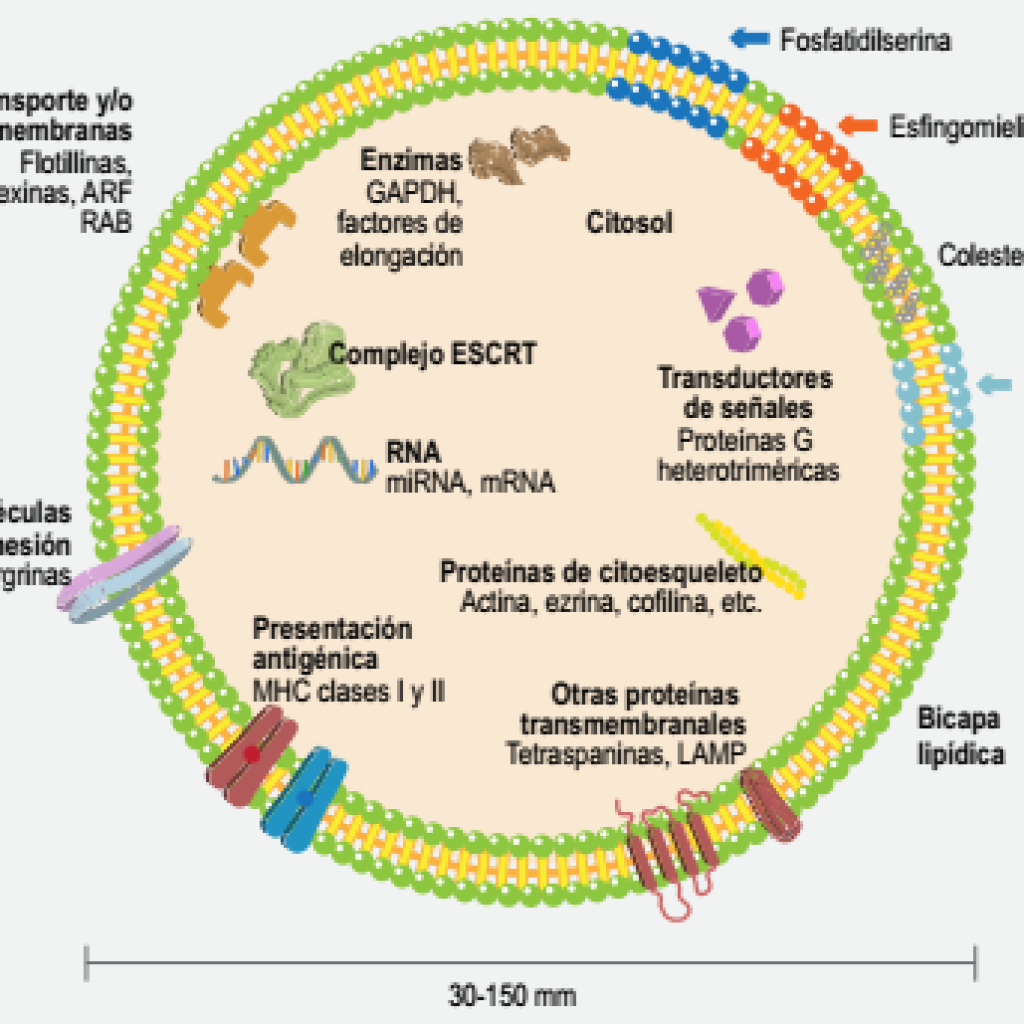
Figura 1. Características y composición de los exosomas. Los exosomas se componen por una bicapa lipídica enriquecida en diversos lípidos, así como diferentes proteínas transmembranales embebidas en dicha estructura. En su interior, estas microvesículas contienen diversas proteínas típicamente citosólicas derivadas de la célula de procedencia con funciones enzimáticas, implicadas en transducción de señales, adhesión, presentación de antígenos o coestimulación y proteínas propias de la génesis exosomal. De igual forma, dicho contenido exosomal incluye usualmente diversos tipos de RNA, incluyendo RNA mensajero (mRNA) así como microRNA (miRNA) y RNA largos no codificantes (lncRNA).
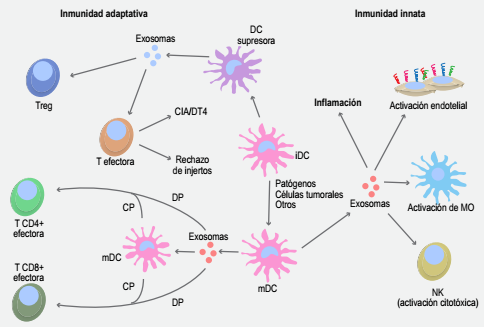
Figura 2. Los exosomas generados por APC modulan las respuestas inmunológicas innatas y adaptativas. Exosomas derivados de DC maduras (mDC) pueden proveer estimulación antigénica a linfocitos T, así como inducir respuestas de tipo innato en diversas células del sistema inmunológico y de otros tipos, promoviendo una respuesta proinflamatoria. En contraparte, lo exosomas liberados por DC inmaduras (iDC) poseen una naturaleza inmunosupresora, siendo capaces de inducir apoptosis en células T efectoras o promover la activación de células con fenotipo regulador (Treg). M0, monocito; NK, célula natural-killer; DP, presentación antigénica directa; CP, presentación antigénica cruzada o cross-presentation; CD, cross-dressing; CIA, artritis inducida por colágeno; DT4, hipersensibilidad tipo 4.
Los exosomas derivados de células dendríticas (DEX) como herramienta inmunoterapéutica. Los exosomas, un subtipo de vesículas extracelulares (EV), son nanovesículas de 30 a 150 nm ricas en lípidos, proteínas y RNA reguladores, como microRNA (miRNA), que desempeñan un papel crucial en la comunicación celular y la modulación del sistema inmunológico.Estos exosomas se producen en condiciones controladas y son particularmente efectivos en la presentación antigénica gracias a la presencia de moléculas del complejo mayor de histocompatibilidad (MHC) y proteínas coestimuladoras. Funcionan mediante tres mecanismos principales: presentación directa de antígenos, presentación cruzada y activación de células T mediante transferencia de complejos MHC-péptido.
El secretoma de las células dendríticas también incluye citocinas, quimiocinas y RNA que modulan respuestas inflamatorias y adaptativas. Además, los exosomas ofrecen ventajas prácticas frente a terapias celulares, como mayor estabilidad, facilidad de almacenamiento y menor susceptibilidad a factores inmunosupresores en el microambiente tumoral.
La administración epicutanea intradérmica de exosomas se realiza en rangos terapéuticos estandarizadas, optimizando la estimulación inmunológica de manera segura y eficiente.
La inmunoterapia DEX se ha consolidado como una innovación en el tratamiento del cáncer, destacándose por su composición única y mecanismos avanzados de acción inmunológica. Cada protocolo, diseñado específicamente para un solo paciente, utiliza exosomas derivados de células dendríticas (DEX), nanovesículas de entre 30 y 100 nm formadas por la gemación interna de membranas endosómicas en cuerpos multivesiculares (MVB).
Estos exosomas se liberan cuando los MVB se fusionan con la membrana celular de las células dendríticas, permitiendo la exposición de un proteoma especializado que potencia su funcionalidad inmunoestimuladora. Entre sus componentes clave, los DEX contienen moléculas de histocompatibilidad MHC-I y MHC-II, esenciales para la activación de linfocitos T CD8+ y CD4+, además de proteínas coestimuladoras necesarias para intensificar las respuestas inmunes.
Los DEX poseen también integrinas (αMβ2, αvβ3 y αvβ5), ICAM-1 y MFG-E8, proteínas que facilitan su acoplamiento con células receptoras y optimizan su absorción. Las tetraspaninas CD9, CD63 y CD81, junto con proteínas citosólicas como las anexinas y TSG101, participan en la organización de microdominios y transducción de señales.
Además, contienen HSC73 y HSP90, miembros de la familia HSP, que actúan como chaperonas de antígeno y aumentan la inmunogenicidad. Los DEX también transportan ARN mensajero (ARNm) y microARN (miR), capaces de influir en las células receptoras mediante modificaciones postranscripcionales, reforzando su papel como una herramienta terapéutica personalizada en la inmunoterapia del cáncer.
Los mecanismos Científicos del Tratamiento Reconocidos en centenares de publicaciones científicas lo hacen único en activar múltiples vías inmunitarias:
- Presentación de antígenos específicos: Activación dirigida de células T.
- Activación de células T CD8+: Destrucción directa de células tumorales.
- Proliferación de células T auxiliares CD4+: Coordinación de la respuesta inmune.
- Activación de células NK: Ataque no específico contra células tumorales.
- Secreción de citoquinas: IFN-γ, IL-12 y TNF-α amplifican la respuesta inmune.
- Inducción de memoria inmunológica: Protección a largo plazo contra recaídas.
- Modulación del microambiente tumoral: para facilitar la destrucción de células cancerosas.
- Presentación cruzada mejorada: Mayor reconocimiento de células tumorales secundarias.
- Regulación del sistema inmunológico: Previene la tolerancia inmunológica a las células tumorales.
- Interrupción de la angiogénesis tumoral: Bloqueo de nuevos vasos sanguíneos que alimentan el tumor.
- Control de la apoptosis tumoral: Inducción de la muerte programada de células cancerosas.
6. Aplicación Clínica
La inmunoterapia DEX destaca por su método de administración NO invasivo en comparación con tratamientos tradicionales. La aplicación es generalmente epicutánea o intradérmica, similar a un tatuaje, y no requiere equipos ni profesionales especializados ni hospitalización, propio de un perfil autoaplicable, como ocurre con la autoaplicacion de insulina diaria por millones de pacientes diabéticos, la cual es incluso más profunda o invasiva, y no exige título, equipamiento o autorización de profesional, para su administración. Aunque la aplicación inicial puede ser asistida por un profesional para evitar errores técnicos, o el tiempo de aprendizaje que demora habituarse, se espera que en el futuro estén disponibles microparches absorbibles, eliminando por completo la necesidad de asistencia clínica.
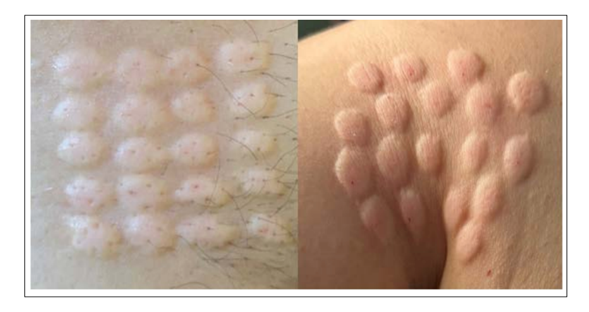
Administración Epicutánea o Intradérmica de Exosomas Derivados de Células Dendríticas. Superficial, No invasiva, de perfil auto aplicable inclusive.
7. Conclusión
La inmunoterapia DEX representa un paso significativo en el tratamiento del cáncer, combinando precisión, personalización y seguridad. Su expansión global y el desarrollo continuo de nuevas tecnologías, como los microparches, prometen democratizar el acceso a esta terapia innovadora. La inmunoterapia basada en exosomas ya cumple con todo el perfil de una herramienta estándar en el control y remisión del cáncer, redefiniendo las perspectivas de los pacientes en todo el mundo.
8. Bibliografía Sugerida
- Pitt JM, Charrier M, Viaud S, André F, Besse B, Chaput N, Zitvogel L. Dendritic cell-derived exosomes as immunotherapies in the fight against cancer. J Immunol. 2014 Aug 1;193(3):1006-11. doi: 10.4049/jimmunol.1400703. PMID: 25049431.
- Zhang, Y., Liu, Y., Liu, H., Tang, W. H., & Chen, Y. (2020). The role of dendritic cell-derived exosomes in cancer immunotherapy. Frontiers in Immunology, 11, 1106. https://doi.org/10.3389/fimmu.2020.01106
- Pitt, J. M., André, F., Amigorena, S., Soria, J. C., Eggermont, A., & Kroemer, G. (2016). Dendritic cell-derived exosomes for cancer therapy. The Journal of Clinical Investigation, 126(4), 1222-1232. https://doi.org/10.1172/JCI81135
- Viaud, S., Théry, C., Ploix, S., Tursz, T., Lapeyre, F., Lantz, O., & Zitvogel, L. (2010). Dendritic cell-derived exosomes promote natural killer cell activation and proliferation: A role for NKG2D ligands and IL-15Rα. PLoS One, 4(4), e4942. https://doi.org/10.1371/journal.pone.0004942
- Pitt JM, Charrier M, Viaud S, André F, Besse B, Chaput N, Zitvogel L. Dendritic cell-derived exosomes as immunotherapies in the fight against cancer. J Immunol. 2014 Aug 1;193(3):1006-11. doi: 10.4049/jimmunol.1400703. PMID: 25049431.
- Zhang, Y., Liu, Y., Liu, H., Tang, W. H., & Chen, Y. (2020). The role of dendritic cell-derived exosomes in cancer immunotherapy. Frontiers in Immunology, 11, 1106. https://doi.org/10.3389/fimmu.2020.01106
- Barile, L., & Vassalli, G. (2017). Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacology & Therapeutics, 174, 63-78. https://doi.org/10.1016/j.pharmthera.2017.02.020
- Sree, V. P., & Bhatnagar, S. (2020). Exosomes: Applications in cancer therapy and the challenges. World Journal of Clinical Oncology, 11(2), 100-111. https://doi.org/10.5306/wjco.v11.i2.100
- Zhang, Y., Liu, Y., & Wang, H. (2019). Exosomes: Biogenesis, biologic function and clinical potential. Frontiers in Oncology, 9, 575. https://doi.org/10.3389/fonc.2019.00575
- Luo S, Chen J, Xu F, Chen H, Li Y, Li W. Dendritic Cell-Derived Exosomes in Cancer Immunotherapy. Pharmaceutics. 2023 Aug 1;15(8):2070. doi: 10.3390/pharmaceutics15082070. PMID: 37631284; PMCID: PMC10457773.
- Li J, Li J, Peng Y, Du Y, Yang Z, Qi X. Dendritic cell derived exosomes loaded neoantigens for personalized cancer immunotherapies. J Control Release. 2023 Jan;353:423-433. doi: 10.1016/j.jconrel.2022.11.053. Epub 2022 Dec 7. PMID: 36470333.
- Wang Y, Xiang Y, Xin VW, Wang XW, Peng XC, Liu XQ, Wang D, Li N, Cheng JT, Lyv YN, Cui SZ, Ma Z, Zhang Q, Xin HW. Dendritic cell biology and its role in tumor immunotherapy. J Hematol Oncol. 2020 Aug 3;13(1):107. doi: 10.1186/s13045-020-00939-6. PMID: 32746880; PMCID: PMC7397618.
- Xie QH, Zheng JQ, Ding JY, Wu YF, Liu L, Yu ZL, Chen G. Exosome-Mediated Immunosuppression in Tumor Microenvironments. Cells. 2022 Jun 16;11(12):1946. doi: 10.3390/cells11121946. PMID: 35741075; PMCID: PMC9221707.
- Aldahlawi AM, Abdullah ST. Dendritic Cell-Based Immunotherapies and their Potential use in Colorectal Cancer Immunotherapy. J Microsc Ultrastruct. 2021 Jul 9;10(3):107-113. doi: 10.4103/jmau.jmau_20_21. PMID: 36504589; PMCID: PMC9728090.
- Huang L, Rong Y, Tang X, Yi K, Qi P, Hou J, Liu W, He Y, Gao X, Yuan C, Wang F. Engineered exosomes as an in situ DC-primed vaccine to boost antitumor immunity in breast cancer. Mol Cancer. 2022 Feb 11;21(1):45. doi: 10.1186/s12943-022-01515-x. PMID: 35148751; PMCID: PMC8831689.
- Xia J, Miao Y, Wang X, Huang X, Dai J. Recent progress of dendritic cell-derived exosomes (Dex) as an anti-cancer nanovaccine. Biomed Pharmacother. 2022 Aug;152:113250. doi: 10.1016/j.biopha.2022.113250. Epub 2022 Jun 13. PMID: 35700679.
- Lu Q, Kou D, Lou S, Ashrafizadeh M, Aref AR, Canadas I, Tian Y, Niu X, Wang Y, Torabian P, Wang L, Sethi G, Tergaonkar V, Tay F, Yuan Z, Han P. Nanoparticles in tumor microenvironment remodeling and cancer immunotherapy. J Hematol Oncol. 2024 Apr 2;17(1):16. doi: 10.1186/s13045-024-01535-8. PMID: 38566199; PMCID: PMC10986145.
- Yao Y, Fu C, Zhou L, Mi QS, Jiang A. DC-Derived Exosomes for Cancer Immunotherapy. Cancers (Basel). 2021 Jul 21;13(15):3667. doi: 10.3390/cancers13153667. PMID: 34359569; PMCID: PMC8345209.
- Tuluwengjiang G, Rasulova I, Ahmed S, Kiasari BA, Sârbu I, Ciongradi CI, Omar TM, Hussain F, Jawad MJ, Castillo-Acobo RY, Hani T, Lakshmaiya N, Samaniego SSC. Dendritic cell-derived exosomes (Dex): Underlying the role of exosomes derived from diverse DC subtypes in cancer pathogenesis. Pathol Res Pract. 2024 Feb;254:155097. doi: 10.1016/j.prp.2024.155097. Epub 2024 Jan 5. PMID: 38277745.
- Safaei S, Alipour S, Bahojb Mahdavi SZ, Shalmashi H, Shahgoli VK, Shanehbandi D, Baradaran B, Kazemi T. Triple-negative breast cancer-derived exosomes change the immunological features of human monocyte-derived dendritic cells and influence T-cell responses. Mol Biol Rep. 2024 Oct 17;51(1):1058. doi: 10.1007/s11033-024-10007-8. PMID: 39417912.
